Lekarstwo na wypadek włosów 2020
Streszczenie:
1. Bakterie degradujące keratynę: Różne szczepy bakterii, takie jak Bacillus licheniformis I Stenotrofomonas maltophilia, okazało się, że ma zdolność degradacji keratyny.
2. Odporność na rozkład: Włosy są odporne na rozkład ze względu na jego skład chemiczny i strukturę, co utrudnia organizmom rozbić.
3. Włosy po śmierci: Po śmierci włosy pozostają suche i twarde, wraz z kościami i paznokciami.
4. Wzrost włosów: Wzrost włosów jest połączony z naczyniami krwionośnymi u podstawy każdego pęcherzyka włosów, a komórki włosów nie są już żywe, zanim dotrą do powierzchni skóry.
5. Kompozycja włosów: Włosy składają się głównie z keratyny, białka, które jest nierozpuszczalne i zawiera elementy budulcowe białka zwane aminokwasami.
6. Wzrost martwych włosów: Wbrew powszechnemu przekonaniu włosy nie rosną po śmierci; wydaje się dłuższe z powodu kurczenia się ciała.
7. Rozkład włosów: Włosy rozkładają się powoli z powodu stabilnej i odpornej struktury keratyny, ale ostatecznie rozpada się.
8. Środowisko pogrzebowe: Na tempo rozkładu włosów mogą wpływać czynniki takie jak gleba, wilgoć, chemikalia i obecność zwierząt.
9. Zachowanie w suchych środowiskach: Włosy są dobrze zachowane w suchych i suchych warunkach, ponieważ drobnoustroje nie kwitną w takich środowiskach.
10. Badania włókien opornych na rozkład: Badanie oporności na rozkład kolagenu i keratyny doprowadziło do wysiłków w tworzeniu silniejszych i biodegradowalnych alternatyw dla tworzyw sztucznych.
Pytania:
1. Jakie są przykłady bakterii degradujących keratynę? Niektóre przykłady bakterii degradujących keratynę obejmują Bacillus licheniformis I Stenotrofomonas maltophilia.
2. Dlaczego włosy są odporne na rozkład? Włosy są odporne na rozkład ze względu na jego skład chemiczny i strukturę, co utrudnia organizmom rozbić.
3. Co pozostaje nienaruszone po śmierci? Po śmierci włosy, kości i paznokcie pozostają suche i twarde.
4. Jak nastąpi wzrost włosów? Wzrost włosów jest połączony z naczyniami krwionośnymi u podstawy każdego pęcherzyka włosów, a komórki włosów nie są już żywe, zanim dotrą do powierzchni skóry.
5. Jaki jest główny element włosów? Głównym składnikiem włosów jest keratyna, białko, które jest nierozpuszczalne i zawiera aminokwasy.
6. Czy włosy nadal rosną po śmierci? Nie, włosy nie rosną po śmierci; wydaje się dłuższe z powodu kurczenia się ciała.
7. Jak rozkładają się włosy? Włosy rozkładają się powoli z powodu stabilnej i odpornej struktury keratyny, ale ostatecznie rozpada się.
8. Jakie czynniki wpływają na tempo rozkładu włosów? Czynniki takie jak gleba, wilgoć, chemikalia i obecność zwierząt mogą wpływać na szybkość rozkładu włosów.
9. Czy włosy są dobrze zachowane w suchych środowiskach? Tak, włosy są dobrze zachowane w suchych i suchych warunkach, ponieważ drobnoustroje nie kwitną w takich środowiskach.
10. Jakie są implikacje badania włókien opornych na rozkład? Badania włókien opornych na rozkład, takie jak kolagen i keratyna, mogą prowadzić do opracowania silniejszych i biodegradowalnych alternatyw dla tworzyw sztucznych.
11. Jak bakterie degradujące keratynę przyczyniają się do rozpadu odpadów rogunkowatego? Bakterie degradujące keratynę mają zdolność do kolonizacji i rozkładania złożonych odpadów rogunkowych.
12. Jaki jest skład chemiczny, który sprawia, że keratyna i kolagen odporne na rozkład? Keratyna i kolagen mają skład aminokwasowy, które przyczyniają się do ich siły i odporności.
13. Czy włosy mogą być trawione przez drobnoustroje lub zwierzęta? Bardzo niewiele drobnoustrojów i zwierząt, takich jak grzyb alternarodowy spp. i chrząszcz dywanowy, może trawić włosy.
14. Jak suche i suche warunki wpływają na rozkład włosów? W suchych i suchych warunkach włosy są lepiej zachowane, ponieważ drobnoustroje nie kwitną w takich środowiskach.
15. Jakie są możliwe zastosowania włókien odpornych na rozkład w przyszłości? Włókna odporne na rozkład, takie jak kolagen i keratyna, mogłyby być użyte do tworzenia silniejszych i biodegradowalnych alternatyw dla tworzyw sztucznych.
Lekarstwo na wypadek włosów 2020
Podobnie jak izolaty grzybów, zgłoszono listy szczepów bakteryjnych zdolnych do degradacji keratyn [140]. Williams [141] Izolowany zrównoważony zmienną gram, tworzenie endosporów, ruchy, bakteria w kształcie pręta i zidentyfikowana jako Bacillus licheniformis PWD-1. Ta izolat wykazał wzrost fakultatywny w temperaturach termofilowych z optymalnym w temperaturze 45–50 ° C i pH 7.5. Deivasigamani i alagappan [9] izolowali keratynolity Bakcyl sp. z rzeźni i farmy drobiu oraz obserwowana maksymalna aktywność keratynazy (122.5 KU/ml) przy pH 8.0. CAO [142] wyizolował bakterię degradującą ojciec ( Stenotrofomonas maltophilia ) od rozkładających piór drobiowych, które wykazały najwyższą aktywność degradującą pióra w 40 ° C i pH 7.5–8.0. Mikroby degradujące keratynę są szeroko rozpowszechnione wśród populacji drobnoustrojów gleby. Te drobnoustroje mają zdolność do kolonizacji i rozkładu złożonych odpadów rogówki.
Co dzieje się z twoimi włosami po śmierci?
Włosy opiera się na rozkładu z powodu keratyny, białka strukturalnego. Struktura i skład chemiczny keratyny utrudniają organizmom rozbić.
Zombie, mumia, wampiry… Te nieumarłe upiory stworzyły kilka mitów w popkulturze na temat tego, co dzieje się z życiem po śmierci. Jednak to, co naprawdę dzieje się z naszymi śmiertelnymi ciałami po tym, jak nasze serca przestają bić?
Znasz ogólny proces: Po zakończeniu procesu rozkładu nasze ciała zaczynają się skurczyć. Pozostaje suche i twarde części – kości, paznokcie i być może najważniejsze… włosy!
Zanim wskoczymy do tego, co dzieje się z włosami po śmierci, spójrzmy na biologię włosów.
Zalecane wideo dla Ciebie:
Jeśli chcesz kupić/licencjonować ten film, napisz do nas na [email protected].
Z czego są włosy i jak rosną?
W życiu wzrost włosów jest bezpośrednio związany z naczyniami krwionośnymi u podstawy każdego pęcherzyka włosów. Te naczynia krwionośne karmią korzenie włosów, aby rosły i przebijają się przez skórę. Zanim włosy dotrą do naskórka (zewnętrzna powierzchnia skóry), komórki w tych włosach nie są już żywe. To’S dlaczego tak się nie dzieje’zranić się, by obciąć włosy… to’S w zasadzie już martwy! Głównym składnikiem włosów jest keratyna, białko, które nie zawiera wody i jest również całkowicie nierozpuszczalne. Powodem tej nierozpuszczalności są aminokwasy – elementy budulcowe białka – które tworzą włosy i strukturę włosów – liniarki i ciasno zwinięte. To sprawia, że włosy jest jednym z najsilniejszych substancji biologicznych w naturze. Przeczytaj także: co’S nauka stojąca za prostownicami/lokami?
Czy rosną martwe włosy?

Jednym z pomysłów, który urzekł naszą zbiorową wyobraźnię, jest to, że twoje włosy będą rosły po śmierci! To jednak jest nieprawdziwy. Ten mit istnieje, ponieważ naprawdę wygląda, jakby włosy na zwłokach same w sobie rosną. Zjawisko to można jednak przypisać, po prostu, dobrej względności ole. Biorąc pod uwagę, że ciała ludzkie składają się z 70% wody, nie jest zaskoczeniem, że znacznie kurczą się po utracie wilgoci. W porównaniu z jego skurczonym wyglądem, zwłoki’Wydaje się, że włosy rosły dłużej. Przeczytaj także: Dlaczego tracimy włosy z głowy, ale nie z reszty naszego ciała?
Czy włosy się rozkładają i jak długo to potrwa?
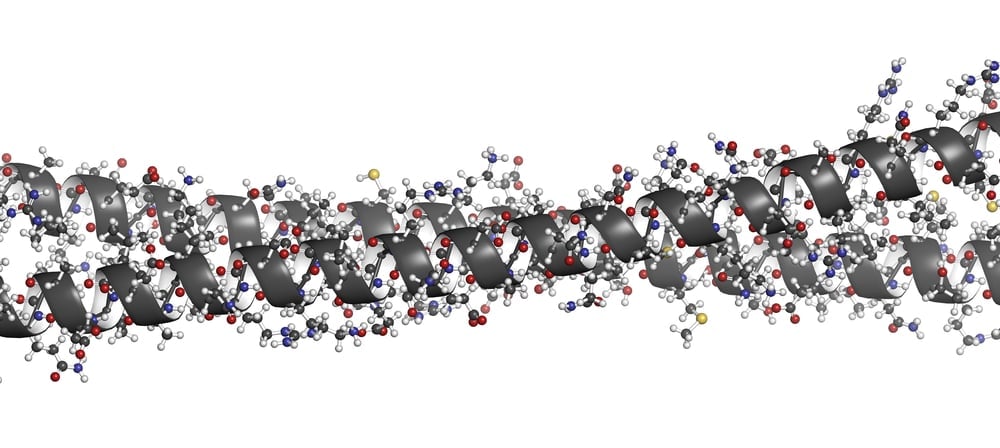
Włosy przetrwają większość innych tkanek miękkich ze względu na nierozpuszczalną i stabilną strukturę keratyny. Jego skład chemiczny utrudnia enzymy proteolityczne – enzymy, które rozkładają białka – rozkładanie włosów. W szczególności aminokwasy histydyna, arginina i lizyna są obfite w keratynie włosów, podobnie jak cysteina aminokwasowa. Wiązania między aminokwasami prowadzą do struktury 3D, która sprawia, że keratyna jest bardzo odporna, a włosy trudne do rozbicia. Bardzo niewiele drobnoustrojów, takich jak grzyb alternaria spp lub zwierzęta, takie jak chrząszcze dywanowe, mogą trawić włosy. Kolagen, który składa się z kości i tkanki łącznej, jest kolejnym białkiem, które opiera się rozkładowi. Ma podobny skład i strukturę do keratyny. Oboje mają skład aminokwasowy, które nadają się do ich siły (chociaż mają kilka różnic w składzie aminokwasowym). Oba są liniowymi i ciasno zwiniętymi białkami z wieloma podjednostkami polipeptydowymi. Właśnie dlatego włosy są jednym z niewielu organicznych reliktów śmierci. Ale nic nie trwa wiecznie, a włosy i kości ostatecznie rozpadają się. Co’S różni się, jak szybko odbywa się proces rozkładu. Środowisko pogrzebowe wpływa na tempo rozkładu w znacznym stopniu. Gleba, wilgoć, chemikalia i zwierzęta znajdujące się w środowisku mogą albo zwiększyć szybkość rozkładu, albo zachować zwłoki. Suche i suche warunki, takie jak te znajdujące się na pustyniach, są doskonałymi konserwami włosów, ponieważ drobnoustroje nie kwitną w takich warunkach. Jednak na większości normalnych gleb zarówno włosy, jak i kość ostatecznie ulegną degradacji po kilku latach. Zarówno kolagen, jak i keratyna mają podobne tajemnice chemiczne do odporności na rozkład. To spowodowało, że laboratoria próbują zsyntetyzować te włókna, aby stworzyć silniejsze, ale ostatecznie biodegradowalne alternatywy dla tworzyw sztucznych. Przeczytaj także: Science of the Skeleton: Dlaczego Don’T krążenia kości?
Czy włosy zmienia kolor po śmierci?

Włosy otrzymują swój kolor z dwóch różnych rodzajów pigmentu: eumelanina i feomelanina. Eumelanina to pigment, który nadaje naszym włosom ciemność, podczas gdy pheomelanina nadaje naszym włosom zaczerwienienie. Twój kolor włosów jest szczególnie charakterystyczny, ponieważ ma własną unikalną kombinację eumelaniny i feomelaniny. Eumelanina ma dwa podtypy: czarny i brązowy. Jeśli masz więcej czarnej eumelaniny we włosach, będzie ona oczywiście ciemniejsza. W konsekwencji, jeśli brakuje całkowitej czarnej eumelaniny i niskiego poziomu brązowej eumelaniny, wówczas istnieje duża szansa na urodzenie z blond włosami. Z wiekiem poziomy obu rodzajów eumelaniny spadają, powodując szarość włosów. Z drugiej strony pheomelanina jest odpowiedzialna za dodanie czerwonego i pomarańczowego. Rzadko zdarza się mieć wysokie stężenie feomelaniny, dlatego na świecie jest tak mało naturalnych rudego. Istnieje jednak w niektórych ilościach u wszystkich’S włosów. Jest również bardziej stabilny niż eumelanina. Eumelanina łatwo się rozkłada przez proces utleniania, ale feomelanina nie. Pheomelanina ma tendencję do kręcenia włosów nawet w ekstremalnych warunkach. Dlatego pod mokrą utleniającymi klimatami eumelanina we włosach jest tracona przez dłuższy czas, pozostawiając czerwony pigment, feomelanina. Krótko mówiąc, odpowiedź brzmi tak! Istnieje szansa, że twoje włosy stają się czerwone po twojej śmierci! Jeśli potrzebujesz punktu odniesienia, powinieneś spojrzeć na starożytnych Egipcjan. Mumie egipskie wydają się mieć zdrowy odcień zamków w kolorze rdzy, pomimo stuleci rozkładu. Proces utleniania trwa dłużej w kontrolowanych suchych warunkach, jak w egipskim grobie. Niemniej jednak natura’t Dyskryminuje. Rude włosy, moda nieumarłych, w końcu do nas dociera. Warto zauważyć, jak przejściowe uważamy za nasze włosy, przekształcanie ich z pewnością, wiedząc, że po prostu odrosnie. Jednak ostatni zestaw mieszków włosowych, które rozwijasz, prawdopodobnie przetrwa w dowolnej cywilizacji, którą nazywasz domem! W końcu nie tak przejściowe. Kto wiedział, że włosy na naszej głowie mogą być tak dynamiczne – nawet po śmierci. Przeczytaj także: Co to jest blade mortis?
Jak długo trwa rozkład włosów?
Wiele lat temu mieszkałem w mieszkaniu w studio, w którym sąsiedzka przyjaciółka z szalonymi długimi, grubymi włosami. Po opuszczeniu mojego stanu nigdy nie miałem częstego gościa z tego rodzaju włosami.
Powodem, dla którego wspominam o tej dziwnej anegdocie, jest to, że nawet ponad rok po tym, jak Roszpon przestał mnie odwiedzić, znalazłem jej długie włosy w odizolowanych miejscach, takich jak zakręty szafy. Wydawało się, że włosy nie rozkładały się i wciąż były w 100 procentach nienaruszone.
Jak długo trwa rozkład włosów?

Przypomniano mi o tym zjawisku przez wideo Tiktok, które stało się popularne w zeszłym tygodniu. Antyczny kolekcjoner kupił książkę z XIX wieku, która zawierała zaskoczenie: koperty nienaruszonych ludzkich włosów schowane na jego stronach. Te włosy miały ponad 150 lat.
Najwyraźniej w tej epoce wiktoriańskiej dla ludzi darowili swoich włosów jako oznaka uczucia i zachować osobę’S Pamięć.
Pomyślałem też o tym zjawisku, kiedy ostatnio oglądałem Sabię i inspirującą Loren w jednym z ich filmów. Najciekawsza część dla mnie dotyczyła Loren’S Zachowane zamki z dzieciństwa. Nadal są w dobrej formie po dziesięciu latach w plastikowej torbie (bez specjalnych chemikaliów ani tłuszczów). Zobacz 7:25 dalej w tym filmie.
Uważam za ironiczne, że włosy składają się z martwego białka keratyny. Jednak gdy zrzuci ze skóry głowy, od lat odmawia rozkładu. Raporty sugerują, że włosy rozkładają się w ciągu dwóch lat, jeśli zostaną pochowane w glebie. W przypadku narażenia na niekorzystne warunki pogodowe, takie jak deszcz, wiatr, śnieg, wilgotność i bezpośrednie światło słoneczne, proces będzie szybszy.
Włosy, które wysyłasz w dół, również rozkładają się znacznie szybciej. Jeśli jednak pozostawiono w pomieszcze.
Rozkład włosów vs
W rzeczywistości, jeśli ostrożnie przechowujesz ludzkie włosy skóry głowy, może trwać tysiące lat. Było to dość często w egipskich mumiach po wykopaliskach. Włosy tych mumii były doskonale zachowane w unikalnym balsamie składającym się z tłuszczu, oleju, gumy i wosku.
Do balsamowania i zachowania całego ciała z poprzednich egipskich królów i królów i królowych użyto również oddzielnej mikstury. W ramach przygotowań do spokojnego życia pozagrobowego.
Co dzieje się z włosami po śmierci?
Pytanie, które wiele osób zadaje, jest tym, co dzieje się z twoimi włosami skóry głowy po śmierci? Czy szybko się rozkłada z powodu braku ciągłego dopływu krwi i odżywiania? Niektóre anegdotyczne raporty sugerują, że po śmierci wciąż rośnie. Jest to jednak fałszywe.
Ani włosy, ani paznokcie nie rosną po śmierci. Odwodnienie ciała prowadzi do wycofania skóry wokół włosów i wokół paznokci. Może to dać zwodnicze pojawienie się dłuższych włosów i paznokci po śmierci.
Ludzkie maty do włosów w celu czyszczenia wycieków oleju
Fakt, że ludzkie włosy są tak mocne i trudne do zniszczenia, doprowadził do kilku interesujących zastosowań. Najbardziej znanym zastosowaniem są peruki, które mogą trwać przez lata. Wiele osób używa również włosów do kompostowania, ponieważ jest to biodegradowalne. Inni eksperymentują z dodawaniem ludzkich włosów jako dodatku do asfaltu w konstrukcji chodnika.
Coraz bardziej popularne nowe zastosowanie znajduje się w zakresie sprzątania wycieków ropy i innych zanieczyszczeń w oceanach. Wielu fryzjerów i salonów otrzymuje wynagrodzenie za wysłanie resztek krojonych włosów do firm, które je używają do takich celów.
Rozkładają włosy?
Wiele osób zastanawia się nad powiązaniami między łysieniem a rozkładem włosów.
Kiedy tracisz włosy, czy włosy umiera i rozpada się? Czy jest jakiś sposób na zatrzymanie tego?
I’wykonałem mnóstwo badań, aby sprawdzić, czy łysienie jest związane z rozkładem, a w skrócie:

Suplement wzrostu włosów damskich nutrafol | W wieku 18–44 |. Klinicznie udowodnione dla wyraźnie grubszych i mocniejszych włosów | Zalecane dermatolog | 1 butelka | Dostawa 1 miesiąca
Amazonka

Suplement wzrostu włosów damskiej nutrafol | Wiek 45+ | Klinicznie udowodnione dla wyraźnie grubszych pokrycia włosów i skóry głowy | Zalecane dermatolog | 1 butelka | Dostawa 1 miesiąca
Amazonka

Vitamix 068051 FoodCycler FC-50, pojemność 2L, szary
Amazonka
- Łysienie i rozkład są’T połączone w ogóle
- Włosy zajmują wieki, aby się rozłożyć
- Ale dziwnie, kiedy to robi, to’s świetny nawóz dla roślin
Chcieć wiedzieć więcej? Czytaj.
Czy ludzkie włosy się rozkładają?
Ludzkie włosy rozkładają się, chociaż może to zająć bardzo dużo czasu. Rozkłada się, ponieważ jest wykonany z materii organicznej – głównym składnikiem włosów (stanowiących około 95% jej struktury) jest białko zwane keratyną, które jest również substancją, która stanowi część naszej skóry i paznokci.
Cała materia organiczna rozkłada się, ale na różne sposoby i przez różne okresy czasu. Zależy to od konkretnej materii i warunków, na które jest narażony.
Keratyna nie zawiera żadnej wody i jest nierozpuszczalna – wygrała’t rozpuszczaj się i jest wodoodporny. Pomaga to spowolnić rozkład, ponieważ woda może tylko pomóc włosom rozłożyć się z zewnątrz. Wiele innych substancji organicznych, które są rozpuszczalne, pochłania wodę, a zatem rozkładają się zarówno wewnętrznie, jak i zewnętrznie.
Oznacza to, że włosy są jedną z bardziej trwałych substancji organicznych, a zatem w zależności od warunków może się wydawać, że nigdy się nie rozkłada, chociaż ostatecznie tak będzie.
Jak długo trwa rozkład włosów?
Włosy zajmuje bardzo dużo czasu, a jeśli zachowane w suchym środowisku, często może trwać dziesiątki, setki lub potencjalnie nawet tysiące lat, jeśli okolica jest zamknięta. Włosy rozpuszczają się najszybciej, gdy mokre, gdzie może potrwać od jednego do dwóch lat.
Ponieważ rozkładanie się włosów zajmuje tak długo, nie’t naprawdę mają dokładne szacunki średnio – to’Zwykle nas przeżyje. Ludzkie włosy albo są zakopane w trumnie, w której są zamknięte (i całkiem dobrze zachowane), albo są spalone.
A kiedy ludzkie włosy albo wypadną, albo zostały wycięte, nie’Zwykle zostawiam go w spokoju, aby monitorować, ile czasu zajmuje rozkład.

Więc co wiemy? Wiemy, że włosy, które zostały zapieczętowane w suchych warunkach, przetrwają wiele lat. Niektóre mumy zostały nawet odkryte w grobowcach ze starożytnych czasów Egiptu, które mają nienaruszone włosy.
I byliśmy w stanie zaobserwować, że gdy mokre włosy zwykle rozkładają się znacznie szybciej. Chociaż jest wodoodporny, woda z czasem zużyje keratynę.
Wiesz, jak twoje paznokcie miękją, jeśli pozostaniesz w wannie przez długi czas? I pamiętaj, jak włosy i paznokcie są wytwarzane z tej samej substancji? To’S Dlaczego ludzkie włosy zmiękną, a następnie ostatecznie rozkładają się w wodzie.
Łysienie i rozkład włosów
Tam nie jest’W każdym związku między łysieniem a rozkładem włosów. Łysienie nie jest spowodowane rozkładaniem włosów szybciej niż powinno. Obaj są niezwiązane. Główną przyczyną łysienia jest zmniejszenie mieszków włosowych, ale pęcherzyki nie rozkładają.
Każdy codziennie traci włosy – zazwyczaj średnio od 70 do 100 włosów (źródło). Łysienie występuje, gdy jesteś’T uprawę włosów, aby je zastąpić. Więc to’nie tak, jakby same włosy umierają szybciej – to’S tylko dlatego, że pęcherzyki są’t Pracując tak, jak powinni.

I istnieje wiele potencjalnych przyczyn, w tym warunki dziedziczne, stres, leki i tak dalej. Ale żadna z nich nie powoduje rozkładu żadnej części włosów ani skóry głowy. Rozkład włosów jest całkowicie niezwiązany z przedmiotem.
Jasne, że to nie’t oznaczają, że możesz być nonszalancki z włosami. Jeśli zacząłeś łysy się i możesz zobaczyć skórę głowy przez włosy, to nie’t oznacza to’rozkłada się, ale oznacza to, że musisz podjąć działania.
To może być próbowanie zabiegów takich jak minoksydyl lub finasteryd, mikropigmentacja skóry głowy (patrz poniżej), a nawet przeszczep włosów, który jest trwałym rozwiązaniem. Na wypadek, gdybyś się zastanawiał, przeszczepy włosów Don’boli tak samo jak ty’D Pomyśl.

Lub może to być po prostu obejmowanie wypadania włosów i golenie łysej głowy.
Ale twoje włosy nie’t faktycznie umiera i rozkłada się, gdy się łysisz. Twoje komórki włosów już są ‘martwy’. Oni’Po prostu nie zastępuje się nowymi martwymi komórkami włosów, gdy zaczynasz łysić.
Same włosy rozkładają się w tym samym tempie, niezależnie od tego, czy są w twojej głowie, czy też wypadły. Niektóre produkty chemiczne mogą uszkodzić pęcherzyki (chociaż szampon przeciw ośłoczeniowej, taki jak głowa i ramiona’T – pomimo niektórych plotek), ale tak są’t bezpośrednio powodujące rozkład.
Czy włosy rozkładają się po śmierci?
Śmierć jest’T powiązane z rozkładem włosów. Włosy rozkładają się w takim samym tempie dla kogoś, kto żyje i kogoś, kto nie żyje. Włosy, gdy wzrośnie przez skórę, już są ‘martwy’ komórki, które zostały uprawiane.
Więc to, czy włosy rozkładają się po śmierci, zależy od przechowywania włosów. Wiemy już, że włosy rozkładają się znacznie szybciej, gdy są narażone na wodę, ale jeśli pozostanie w zamkniętym i suchym miejscu, rozkłada się w bardzo wolnym tempie.
Oznacza to, że po śmierci, jeśli zostaniesz pochowany w drewnianej trumnie, twoje włosy mogą być zachowane przez bardzo długi czas. Podczas gdy jeśli wybierzesz biodegradowalną trumnę, twoje włosy będą narażone na glebę i rozkładają się.
Oczywiście, jeśli masz kremowane, twoje włosy wygrały’t Rozkład – to’Spal.
Czy włosy rozkładają się w glebie?
Włosy rozkładają się w glebie szybciej niż by to zrobić. Połączenie minerałów w glebie i wilgoci przyspieszy proces rozkładu. To’S wciąż powolny, ale spodziewaj się, że zajmie to od jednego do dwóch lat, zamiast dłużej.
Ale to’warto wiedzieć, ponieważ włosy mogą być faktycznie stosowane jako nawóz dla roślin. Po rozpoczęciu procesu rozkładu włosy zaczną uwalniać azot.
Azot jest istotnym składnikiem, który pomaga roślinom rosnąć, i pomimo jego obfitości w otaczającym nas powietrze, rośliny wygrały’Zbierz go w tej formie. Zamiast tego często używamy chemikaliów takich jak amoniak jako nawóz, aby zapewnić azot bezpośrednio do korzeni.
Ludzkie włosy są oczywiście znacznie zdrowsze niż amoniak, ponieważ nie są’T ostra chemikalia, tak stosowana jako nawóz, może być znacznie bardziej przyjaznym dla środowiska.
Ale Don’Nie zapomnij o minusie tego długiego czasu plonu – jeśli dodasz włosy do gleby, wygrał’t mają bezpośredni wpływ. Zamiast tego użyj go dla roślin o dłuższych czasach uprawy i skorzystają więcej.
To’jest również ważne, aby nie dodawać włosów do gleby, która została poddana chemicznie, takim jak bielone lub barwione włosy. Te chemikalia mogą również dostać się do gleby i będą szkodliwe dla twoich roślin.
Czy włosy rozkładają się na drenażu?
Ludzkie włosy rozkładają się w twoich rurach spustowych, ale znowu to’Wciąż trwa do dwóch lat. Jeśli masz zatkany drenaż, nie możesz długo czekać, aż zatkan się rozpadnie, więc ty’Zwykle musi podjąć inne działania, aby usunąć włosy.
Istnieje wiele chemikaliów, które są żrące i mogą pomóc zniszczyć włosy, które usuną wszelkie chodaki w drenażu. Tylko bądź ostrożny, ponieważ korozyjne chemikalia mogą również zniszczyć same rury. Użyj specjalistycznych produktów do pracy, które są zrównoważone we właściwy sposób, aby zniszczyć blokady bez uszkodzenia odpływów.
Jeśli twoja toaleta została zatkana włosami – powiedz, że ktoś postanowił wrzucić tam ścinki włosów zamiast w śmieci – powinieneś być bardziej ostrożny przy użyciu środków chemicznych przez.
Kiedy włosy zostaną zniszczone w ten sposób, reakcja uwolni ciepło. Podczas gdy rurociąg z tworzyw sztucznych i metalowych może utrzymać to ciepło, porcelana może pękać. Zatem w szczególności z blokadami toalet, spróbuj używać narzędzi, a nie chemikaliów.
Jeśli blokada wydaje się być dalej w dół toalety i do rur, zwykle wystąpi produkty rozpuszczające.
Czy włosy rozkładają się po cięciu?
Włosy, które zostały wycięte, rozkładają się z tą samą prędkością, co włosy wciąż w głowie – zależy od warunków przechowywania włosów. Jeśli włosy są przechowywane w suchym miejscu z dala od enzymów bakteryjnych, to’LL trwają bardzo długi czas.
Więc właściwie jeśli ty’ve miała fryzurę, może być zła rzecz wyrzucania sadzonek do śmieci. Rozpad.
Używanie ciętych włosów jako nawozu gleby lub wrzucanie ich do pojemnika kompostowego jest najlepszą rzeczą, jaką możesz z tym zrobić. Nawet jeśli nie’t jesteś ogrodnik, ty’Przynajmniej pomagając mu szybciej się rozbić.
Streszczenie
Więc masz to. Jeśli ty’Złysa, twoje włosy są’t rozkładanie – co brzmiałoby nieco makabrycznie. A przynajmniej to’nie rozkłada się szybciej niż ktoś’s włosy, które są gęste i pełne.
Łysienie jest’t spowodowane rozkładem, a włosy osoby łysej nadal będą trwać bardzo, bardzo długo – po prostu nie w głowie.
I’D Zalecaj kompostowanie włosów, jeśli możesz, nawet jeśli nie masz’t Planowanie uprawy roślin. Zawsze możesz przekazać kompost bogaty w azot temu ogrodnikowi w Twojej okolicy.
Zainteresowany przeczytaniem więcej o nauk o włosach? Tutaj’S Spójrz na to, czy słona woda jest dobra dla twoich włosów.
Jak przydatne był ten post?
Kliknij gwiazdę, aby ją ocenić!
Średnia ocena 0/5. Liczba głosowania: 0
Do tej pory nie ma głosów! Być pierwszym, który oceni ten post.
Jak uznałeś ten post przydatny.
Śledź nas w mediach społecznościowych!
Przykro nam, że ten post nie był dla Ciebie przydatny!
Popraw ten post!
Powiedz nam, jak możemy poprawić ten post?

Ten post został napisany przez Matt:
Goliłem głowę od prawie 20 lat. Jestem tutaj, aby podzielić się tym doświadczeniem, dobrym i złym, pomóc ci przyjąć utratę włosów i żyć najlepszym łysym życiem.
Odpady keratyny: biodegradowalne polimery
Keratyny są wszędzie, od bycia głównymi składnikami pyłu gospodarstwa domowego po zwykłe zanieczyszczenia analizy białek laboratoryjnych. Keratyna jest głównym strukturalnym białkiem włóknistym należącym do dużej rodziny białek strukturalnych z tworzenia włosów, wełny, piór, paznokci i rogów wielu rodzajów zwierząt i ma wysokie stężenie cysteiny, 7–20% całkowitych reszt aminokwasowych, które tworzą między- i śródkularne wiązania disurek. Odpady keratyny są uważane za zanieczyszczenia środowiska i produkowane głównie z farm drobiu, rzeźb i branż skórzanych. Odpady keratyny są zrzucane, zakopane, wykorzystywane do składowiska lub spopie, a wszystkie te działania zwiększają zagrożenia związane z zagrożeniami środowiskowymi, zanieczyszczenie, negatywnie wpływają na zdrowie publiczne i zwiększają stężenie gazów cieplarnianych. Natura dostarczyła planecie Ziemia różnorodne korzystne organizmy. Gleba jest uważana za znane źródło wzrostu mikroflory keratynofilowej (grzyby i bakterii), które mają zdolność degradacji odpadów keratyny. Zdolność degradacji keratyny mikroflory keratynofilowej została przypisana produkcji mikrobialnej enzymu keratynazy i biodegradacji (degradacja enzymatyczna) (degradacja enzymatyczna). Tak więc odpady keratyny są biodegradowalnymi polimerami. Keratynaza to znaczący przemysłowy enzym, który oferuje biokonwersję odpadów keratynowych, wykorzystanie jako suplementy pasz dla zwierząt oraz środki dehairingowe w branżach garstki i branżach tekstylnych.
Słowa kluczowe
- keratyna
- Zanieczyszczenia środowiska
- Keratynofilowa mikroflora
- Biodegradowalne polimery
- keratynaza
Informacje o autorze
Tarun Kumar Kumawat
- Therachem Research Medilab (India) Pvt. Sp. z o.o., Indie
Anima Sharma *
- Department of Botany, Maharshi Dayanand Saraswati University, Indie
Vishnu Sharma
- Department of Botany, Mehta PG College, Indie
Subhash Chandra
- Department of Zoology, Maharshi Dayanand Saraswati University, Indie
*Zwróć się do całej korespondencji do: [email protected]
1. Wstęp
Odpady keratyny są uważane za zanieczyszczenia środowiska i generowane głównie z farm drobiu, ubojów i branż skórzanych [1, 2]. Farmy drobiowe, rzeźnie, branże skórzane i branże wełny stale produkują milion ton odpadów keratynowych [3]. Skórzane branże wyrzucają obszerną ilość odpadów i uważane za przemysł zanieczyszczenia o negatywnym wpływie na środowisko [4]. Główny producent odpadów keratyny obejmuje Stan.
Białko keratyny jest głównym składnikiem odpadów keratyny [7] i należy do grupy skleoproteinowej [8]. Białko keratyny jest znacznie odporne na działanie środków fizycznych, chemicznych i biologicznych [9]. Pióra drobiu i inne odpady zawierające keratynę są porzucane, lądowe i spalane na całym świecie [10, 11]. Działania te powodują zanieczyszczenie gleby, wody i powietrza. Odrzucone pióro Ponadto powoduje różne choroby ludzkie, w tym chlorozę i cholerę ptactwa [12].
Bardzo niewiele mikroorganizmów jest w stanie rozbić białko keratyny i wykorzystać je jako źródło odżywiania [13]. Natura zapewniła Ziemi asortyment korzystnych organizmów. Mikroflora keratynofilowa (grzyby i bakterie) to natura’S Prezent i największa grupa organizmów, które mają zdolność degradacji odpadów keratyny [14, 15]. Biologiczna degradacja odpadów keratyny jest bardziej wydajna niż degradacja fizyczna i chemiczna, zapewniając bardziej użyteczny produkt uboczny, który można wykorzystać w zastosowaniach komercyjnych. W tym scenariuszu degradacja biologicznych odpadów keratynowych otrzymała rozważanie od społeczności badań naukowych w ostatnich dniach [16, 17].
2. Białko keratyny
Keratyna jest nierozpuszczalnym białkiem, które tworzy główny składnik zewnętrznej warstwy naskórka i pomaga zapobiec utratę płynów ustrojowych [9, 14, 18]. Keratyna początkowo pojawia się w literaturze około 1850 r., Aby opisać, że keratyna składa się z twardych tkanek [19]. Keratyna jest najbardziej złożonymi białkami komórek nabłonkowych kręgowców [20, 21]. Białko keratyny jest twardym, włóknistym i trzecim najliczniejszym polimerem w środowisku po celulozie i chitynie [22, 23].
Według zawartości siarki białka keratyny są podzielone na (a) miękkie keratyny – skórę i kalus (b) twarde keratyny – pióro, włosy, kopyta i [24, 25, 26]. To białko należy do grupy skleoproteinowej [27, 28]. Trwałość keratyn jest bezpośrednią konsekwencją ich złożonej architektury o wyjątkowo wysokiej masie cząsteczkowej [29, 30]. Białko keratyny nie jest łatwo degradowane przez pepsynę, trypinę i papainę z powodu wiązań disiarczkowych, wiązania wodorowego, interakcji hydrofobowych [31, 32, 33, 34].
2.1. Rodzaje keratyny
Istnieją dwa rodzaje keratyny.
2.1.1. Alfa keratyna (α-keratyna)
Keratyna alfa występuje w nabłonku wszystkich kręgowców [35]. Helisa α w keratynie alfa stanowi problem środowiskowy ze względu na ich odporność na degradację z drobnoustrojów [36, 37]. W szczególności alfa keratyny są niezwykłe ze względu na ich siłę, elastyczność, wytrzymałość, nierozpuszczalność i elastyczność. Alfa (α) keratyna ma obfite ilości hydrofobowego aminokwasu, i.mi. metionina, fenyloalanina, walina, izoleucyna i alanina [38]. Według zawartości siarki białko to jest klasyfikowane w twardej i miękkiej keratyn [39].
2.1.2. Beta keratyna (β-keratyna)
Beta-keratyna jest białkiem strukturalnym i występując w gadach i ptakach [40]. Beta (β) keratyna ma wysoki procent cysteiny, a cysteina łatwo tworzy wiązania disiarczkowe, które nadają sztywność i zapewniają zwiększoną odporność na degradację [41]. W dojrzałym piórku występuje około 80–90% β-keratyny [42]. Masa cząsteczkowa poszczególnych białek keratyny jest zwykle w zakresie 10–14 kDa [43, 44].
3. Główne źródło białka keratyny
Białko keratyny wywodzi się z żywego organizmu lub z części ciała po śmierci. Najbogatsze źródła keratyny to pióra, wełna, włosy, kopyta, łuski i warstrowanie rogów (ryc. 1) [27]. Włosy są produktem ubocznym z opalenizn podczas procesu fryzury [45]. Białko keratyny jest obecne we włosach ludzkich i oferuje elastyczność, siłę i trwałość włosów w postaci różnych konformacji [46, 47]. Ptak’Pióro składa się z ponad 90% białka keratyny i wytwarzane jako marnotrawstwo przez branże przetwarzające drobiu [48].

Ludzkie włosy są naturalnym nitkowatnim biomateriałem i chemicznie, około 80% białka keratyny jest obecne u ludzkich włosów [49]. Akumulacja włosów powoduje wiele problemów środowiskowych i uważa się za białko odpadowe [50]. Pióra chronią ptaki przed zimnem, deszczem, słońcem i obrażeniami [51]. Pióro kurczaka składa się z około 90% keratyny [52], która jest włóknistym i nierozpuszczalnym białkiem strukturalnym składającym się z cewek-helikalnych połączonych połączeń disiarczkowych [53]. Ta funkcja strukturalna umożliwia mu odporność na niekorzystne warunki środowiskowe i degradacja przez proteazy [16]. Dlatego pióra są uważane za odpady biologiczne i powodują poważne problemy środowiskowe [54].
Ludzki paznokieć jest ważnym narządem ludzkiego ciała i składa się przede wszystkim z wysoce usieciowanej sieci keratyny, skleroproteiny zawierającej duże ilości siarki (3.8%) z kilkoma powiązaniami disiarczkowymi. Ta unikalna struktura powoduje wysoce skuteczną barierę przepuszczalności [55]. Dzień ptaków ma zewnętrzną skorupę twardej keratyny, która składa się prawie w całości z białek [56]. Strukturalnie kopyta keratyna zawiera konformację α-heliczną z domieszką β-arkuszu i ma wysoką stabilność termiczną [57].
Róg jest twardą tkanką zwierząt i ma nieelastyczną konfigurację ze względu na połączenie krzyżowe siarki [58, 59]. Podstawowymi składnikami wszelkich rogów są keratyna, wolne aminokwasy, peptydy, lipidy, pozostają mikroelementy: wapń, aluminium, chrom, miedź, żelazo, mangan i cynk [60]. Białko keratyny w rogu zwierząt jest twardym błonnikiem, a jego leczenie jest bardzo trudne [61].
4. Wpływ odpadów keratyny na zanieczyszczenie środowiska i zdrowie ludzkie
Przemysł stał się istotną częścią współczesnego społeczeństwa, a produkcja odpadów jest nieuniknionym rezultatem działań rozwojowych. Odpady keratyny są produkowane w ogromnych ilościach z komercyjnych zakładów przetwarzających drobiu, branż skórzanych, przemysłu wełny, przemysłu tekstylnego i rzezi (ryc. 2). Odpady te mogą stanowić potencjalne zagrożenie dla zdrowia ludzkiego lub środowiska (gleba, powietrze, woda) [1].

4.1. Odpady keratyny z branży drobiu
Pióra z kurczaka wytwarzanego w dużej ilości jako produkt uboczny odpadowy zakładu przetwarzania drobiu. Na całym świecie, około 8.5 miliardów ton piór drobiowych jest generowane rocznie, z czego Indie’sam wkład wynosi 350 milionów ton. Gromadzenie piór z kurczaka doprowadzi do zanieczyszczenia środowiska [12, 62, 63]. Pióro kurczaka powoduje zanieczyszczenie środowiska, a także negatywnie wpływa na ludzi’życie żyjące w pobliskich miejscowościach [64].
4.2. Marnotrawstwo keratyny z rzezi
Odpady keratyny są wytwarzane z przemysłu mięsnego (rzezi) w postaci piór z kurczaka, dziób, mieszanki kości, narządów i twardych tkanek w bardzo dużej ilości. Odpady rogunkowe są bardzo powoli degradowane i uważane za niebezpieczne odpady zgodnie z dyrektywami UE [65]. Zanieczyszczone ścieki wytwarzane z takich branż spowodowały problemy zakwaszenia gleb, eutrofizacji i zmniejszonej różnorodności gatunków. Konwencjonalne metody zastosowane do usuwania odpadów keratynowych są nie tylko kosztowne, ale także bardzo trudne. Zastosowane są metody dekompozycji, takie jak spalanie [20], ale procedury te są zapylanie środowiska i stanowią ryzyko dla środowiska [66].
4.3. Odpady keratyny z przemysłu skórzanego
Skórzane branże to najbardziej zanieczyszczające branże na całym świecie. Przetwarzanie skóry jest odpowiedzialne za niekorzystny wpływ na środowisko [67, 68]. Odpady keratyny wytwarzane z branż skórzanych w bardzo dużych ilościach obejmują zarówno odpady stałe, jak i płynne, które są głównie pochodzenia zwierzęcego [69]. Znaczna ilość odpadów białkowych keratyny, takich jak włosy, rogi i kopyta, są wyrzucane przez skórzane branże [20]. Tannery Industries wypisuje odpady i powodujące poważne problemy zdrowotne, a także zanieczyszczają powietrze, glebę i wodę [70].
4.4. Odpady keratyny ze sklepów fryzjerskich
Sklepy stylistów fryzjerskich i włosów są również najważniejszymi źródłami zanieczyszczenia keratyny. Ludzkie włosy są uważane za zanieczyszczenie środowiska i uważane za odpady miejskie na świecie [71]. Na obszarze miasta często gromadzi się w dużych ilościach, ponieważ odpady stałe i dusi systemy drenażu. Na obszarach wiejskich włosy są wyrzucane w naturze, gdzie powoli rozkładają się przez kilka lat. Otwarte zrzuty włosów wytwarzają płuczkę włosów, co powoduje dyskomfort dla osób mieszkających w tych obszarach i, jeśli są wdychane w dużych ilościach, może powodować kilka problemów z oddychaniem [50].
5. Tradycyjne strategie usuwania odpadów keratyny i ich wad
Każdego roku na całym świecie zabija około 24 miliardów kurczaków, a ogromna ilość piór drobiowych produkuje na całym świecie [72, 73], oprócz gromadzenia ludzkich włosów w obiektach oczyszczania odpadów na całym świecie [51]. Odpady stałe keratyny wytwarzane z mięsa, przetwarzania drobiu, przemysłu rybnego, wełny przemysłu uważane za szkodliwe zanieczyszczenia środowiska [74, 75].
Z powodu patogenicznych drobnoustrojów na odpadach keratyny konieczne stało się wydajne i natychmiastowe oczyszczanie odpadów keratyny [76]. Ogromna objętość odpadów keratynowych stwarza poważny problem ze odpadami stałymi w wielu krajach [77]. Odpady keratyny są powiązane z ewolucją zapachów i patogenów w glebę i wodę [78]. Usuwanie odpadów keratynowych jest dość trudne [79].
Biorąc pod uwagę ogromną wygenerowaną ilość, istnieją cztery metody radzenia sobie z odpadami keratyny: spalanie, składowiska, kompostowanie i szlifowanie mechaniczne (ryc. 3) [20].

5.1. Spopielanie
Spalanie obejmuje spalanie odpadów keratyny i niszczenie potencjalnych czynników zakaźnych [80]. Spalarnia’S Temperatury są powyżej 850 ° C i głównie odpady są przekształcane w CO2 i woda [81]. Ze względu na wymaganie wysokiej temperatury koszty operacyjne są nie tylko drogie, ale także trudne do utrzymania [6]. Spalanie prowadzi do uwolnienia zanieczyszczeń do atmosfery, powodując nieprzyjemne zapachy i przyczynia się do szkodliwego spływu, co negatywnie wpływa na obszary otaczające i niższe, w tym zwierząt gospodarskich i pobliskich ekosystemów [50].
5.2. Składowanie składowiska
Tradycyjną metodą usuwania odpadów keratyny jest wypełnienie gruntów [20, 79]. Historycznie wysypiska były najpopularniejszymi metodami zorganizowanej usuwania odpadów i nadal pozostają w kilku miejscach na całym świecie [82]. Niewłaściwe usuwanie odpadów keratyny przez składowanie składowiska przyczynia się do szkód środowiskowych i przenoszenia chorób [83]. Napełnianie gruntów stanowi również problemy, takie jak odciek składowiska i gazy cieplarniane [84]. Odcieranie zwiększa stężenie azotu w okolicznych obszarach, co prowadzi do kwiatów glonów i szkody ekosystemu [50]. Tak więc składowanie składowiska jest tańszym sposobem odrzucania odpadów keratyn, ale nie jest to wydajna metoda.
5.3. Kompostowanie
Kompostowanie jest dodatkową ekonomiczną metodą recyklingu odpadów piór. Dziewięćdziesiąt procent ciężaru pióra składa się z surowego białka keratyny, a także zawiera 15% N [85, 86]. Kompostowanie to aerobowy proces biologiczny degradujący materiał organiczny drobiu, odpadów uboju, obornika i śmieci. Proces ten zmniejsza patogeny, a produkt kompostowy może być stosowany jako nawóz glebowy [87, 88, 89].
5.4. Mechaniczne szlifowanie
Metodą usuwania odpadów keratyny jest mechanicznie rozkładanie go na przydatne produkty. W tym procesie pióra drobiu hydrolizują pod ciepłem i ciśnieniem, a następnie szlifują i suszenie. Suszone odpady zmielone w proszek, a później przetworzone na przydatne produkty [90]. Martwa proszek może być stosowany jako źródło azotu dla pasz dla zwierząt (głównie przeżuwacze) lub jako organiczny wzmacniacz gleby [91]. Istnieją pewne wady mechanicznej metody szlifowania. Niezwykle wysoka temperatura i szlifowanie powoduje utratę kilku cennych aminokwasów [69, 92].
Usuwanie odpadów keratyny z spalania, składowisk, kompostowania i szlifowania mechanicznego jest ograniczone ze względu na ogromną produkcję szkodliwych gazów i stanowi ryzyko dla środowiska [66]. Biorąc pod uwagę wady przede wszystkim, zarządzanie odpadami keratyny przy użyciu mikroorganizmów wydaje się być opłacalną opcją, a zatem przyciąga naukowców do badań w tej dziedzinie.
6. Techniki hydrolizy odpadów keratynowych
Zarządzanie odpadami keratynowymi wytwarzanymi w branżach drobiu, branżach skórzanych i rzeźnych jest głównym problemem wielu narodów na całym świecie [93, 94]. Dlatego w ciągu ostatnich kilku lat badano liczbę metod, w tym hydrotermalne, chemiczne, enzymatyczne lub biologiczne w celu poprawy strawności piór (ryc. 4) [20, 95, 96].

6.1. Metoda hydrotermalna
Proces hydrotermalny zwykle wykorzystuje wysoką temperaturę (80–140 ° C) i wysokie ciśnienie pary (10–15 psi) z dodaniem kwasów lub zasad do degradacji odpadów keratyny [97, 98]. Ta metoda zużywa wysoką ilość energii i dodanie kwasów (HCL) lub zasad (NaOH), które łamią wiązania peptydowe keratyny [99, 100]. Hydrotermalna hydroliza degradacji wymagała również dłuższego czasu (16 godzin) na degradację piór [20].
Białko keratyny nie jest degradowane przez trypsynę, pepsynę i papainę w stanie natywnym, z powodu wielu wiązań disiarczkowych [4]. Odpady keratyny są usuwane poprzez przetwarzanie termiczne zgodnie z przepisami zdrowotnymi. Produkt popiołu uzyskany z tego procesu jest bogaty w makroskładniki, a także mikroelementy odżywcze. Te elementy mają wysoką wartość nawożenia [97]. Ostatnie procesy oczyszczania hydrotermalnego są kosztowne, a także niszczą aminokwasy i zawierają aminokwasy nie ożywione, takie jak lantionina i lizynoalanina [70, 101, 102].
6.2. Metoda chemiczna
Proces hydrolizy chemicznej odpadów keratyny oparty jest na chemikaliach (kwas, zasada, katalizator). Hydroliza chemiczna wymaga bardziej agresywnych warunków reakcji (wysoka temperatura i ciśnienie) i ma większe ryzyko dla środowiska [103]. Reakcja hydrolizy chemicznej jest wolniejsza i wysoce wydajna, ale powoduje utratę niektórych aminokwasów, E.G. tryptofan [76]. Metody chemiczne wymagają więcej czasu, chemikaliów i energii z drogim sprzętem przemysłowym do przetwarzania. Produkt ma niską wartość odżywczą, ponieważ zawiera niewielkie ilości niezbędnych aminokwasów. Rozpuszczalność i stabilność hydrolizatów zależą od stopnia degradacji białka [99].
Proces hydrolizy chemicznej zwiększa emisję niektórych gazów, takich jak CO, więc2 do środowiska i powoduje choroby oddechowe, choroby sercowo -naczyniowe i raka, między innymi chorobami [16]. Stąd istnieje pilna potrzeba opracowania biotechnologicznych i ekologicznych alternatyw dla recyklingu odpadów keratynowych.
6.3. Metoda biologiczna
Biorąc pod uwagę silne implikacje zanieczyszczające i koszty termoenergetyczne powyższych podejść do oczyszczania odpadów keratyny, degradacja mikrobiologiczna/ metoda biologiczna jest alternatywną, opłacalną i bezpieczną ekologicznie metodą [104, 105]. Enzymy keratynazy wytwarzane przez mikroorganizmy są możliwą alternatywą dla przekształcania odpadów keratyny w bogatą w składniki odżywcze paszę zwierząt [106, 107]. Bardzo niewiele mikroorganizmów wykorzystuje keratynę przez trawienie enzymatyczne jako źródło substratu składników odżywczych do wzrostu. Te mikroorganizmy nazywane są mikroflorą keratynofilową.
Mikroflora keratynofilowa stanowi znaczący składnik gleby i ważną grupę grzybów, bakterii i owadów, które degradują wysoce stabilne białka zwierzęce na Ziemi z powodu uwalniania keratynaz [14, 34, 108, 109]. Keratynaza drobnoustrojów jest enzymem proteolitycznym, który ma zdolność do degradacji nierozpuszczalnego białka keratyny [110, 111, 112]. Enzymatyczna zdolność degradującego mikroorganizm keratyny do rozkładu keratyny od dawna jest interpretowana jako kluczowa innowacja [113]. Enzymy keratynazy mają masę cząsteczkową od 18 do 240 kDa [114, 115].
Biologiczna degradacja odpadów keratyny jest bardziej wydajna niż degradacja hydrotermalna i chemiczna, co powoduje bardziej użyteczny i wolny od toksyny produkt. Zatem przy zastosowaniu tej zdolności mikroorganizmów keratynofilowych w skali przemysłowej, wpływ na spalanie i składowiska na środowisko można w dużym stopniu zmniejszyć.
Degradacja keratyny drobnoustrojów następuje po sekwencji adhezji, kolonizacji, amplifikacji keratynazy realizowanej przez rozkład i deprywację substratu [116]. W procesie degradacji keratyny drobnoustrojów mikroorganizmy’ Wstępne zużywa lipidy (elementy niehernatyczne), a następnie zaczyna degradować keratynę [117]. Degradacja keratyny obejmuje dwa główne działania, tj.mi., Sulfitoliza (rozkład wiązań disiarczkowych) i proteoliza (atak proteolityczny) przez proteazy keratynolityczne (keratynazy) w oparciu o charakter złożoności keratyny [16, 106, 109]. Sulfitoliza jest głównym procesem keratinolizy [118]. W tym procesie mikroorganizmy Siarfik rozładowywania, który jest odpowiedzialny za rozkład keratyny’S wiązania disiarczkowe [14]. W proteolizie bakterie i grzyby są w stanie wykorzystywać substraty rogówki, ze względu na ich zdolność do wydzielania pozakomórkowego enzymu keratynazy do pożywki [22, 105].
Keratynofilowe drobnoustroje atakują substraty keratyny w glebie lub na glebie; Dlatego odbywa się biodegradacja [27, 119]. Kilka szczepów drobnoustrojów może być cennych, ponieważ mają one bardzo znaczącą zdolność degradacji [94]. Grzyby degradujące keratynę są ważną dla środowiska grupą grzybów i uważane za saprofity glebowe [120, 121]. Gleba jest bogata w białko keratyny, więc grzyby keratynofilowe łatwo występują i rosną [122, 123]. Degradujące keratynę grzyby kolonizują odpady keratyny i degradują je w niską masę cząsteczkową [124, 125]. Większość grzybów keratynofilowych należy do rodzin Arthodermataceae i OnyGenaceae w Ascomycetes. Gatunki keratynofilowe należą do rodzajów Chrysosporium , Mikrosporum , Trichophyton , Aspergillus , Fusarium , I Uncinocarpus [126]. Te grzyby są aktywnymi producentami pozakomórkowej keratynazy, mogą być stosowane w bioremediacji takich odpadów i odpadów [14, 127].
Zgłoszono szereg szczepów bakteryjnych do degradacji keratyny. Bakterie mogą rosnąć szybciej niż gatunki grzybowe, a zatem mają potencjał w zastosowaniach przemysłowych. Degradacja keratyny jest głównie ograniczona Bakcyl , Microbacterium, Lysobacter , Nesterokia I Kocuria (Bakterie Gram-dodatnie) i Vibrio , I Xanthomonas I Chryseobacterium (Bakterie Gram-ujemne) [128, 129]. Maksymalne zdolności degradujące pióra są obserwowane głównie w szczepach Bacillus licheniformis [31, 130] i rzadziej w populacjach Bacillus pumilus , Bacillus cereus I Bacillus subtilis [131]. Bakterie degradujące keratynę są Burkholderia , Chryseobacterium , Pseudomonas , Mikrobakterium sp ., Vibrio, Flavobacterium, I Thermoanaerobacter [132, 133].
Badania grzybów keratynofilowych rozpoczęły się w 1952 roku od odkrycia techniki przynęt włosów. Ta technika ułatwiła badaczy do izolacji grzybów od gleby na całym świecie [134]. Otcenasek [135] zgłosił ogólnoświatowy rozkład mikobioty keratynofilowej w glebie. Większość grzybów degradujących keratynę należy do rodzin Arthodermataceae i Onygeneaceae Order Onygenales w Ascomycetes. Wzrost grzybów w temperaturze w zakresie od 15–35 ° C, a niektóre wymagają zakresu wysokiej temperatury dla optymalnego wzrostu [29, 136]. Grzyby rosną w neutralnym pH do słabego kwaśnego środowiska, z najwyższym produkcją grzybni. Optymalne pH 5.0–8.0 jest odpowiednie do produkcji konidialnej i sporulacji w płynnych pożywkach [137, 138]. Badanie aktywności keratynolitycznej grzybów badano za pomocą degradacji piór kurczaka w podstawowej pożywce soli (BSM) [139].
Podobnie jak izolaty grzybów, zgłoszono listy szczepów bakteryjnych zdolnych do degradacji keratyn [140]. Williams [141] Izolowany zrównoważony zmienną gram, tworzenie endosporów, ruchy, bakteria w kształcie pręta i zidentyfikowana jako Bacillus licheniformis PWD-1. Ta izolat wykazał wzrost fakultatywny w temperaturach termofilowych z optymalnym w temperaturze 45–50 ° C i pH 7.5. Deivasigamani i alagappan [9] izolowali keratynolity Bakcyl sp. z rzeźni i farmy drobiu oraz obserwowana maksymalna aktywność keratynazy (122.5 KU/ml) przy pH 8.0. CAO [142] wyizolował bakterię degradującą ojciec ( Stenotrofomonas maltophilia ) od rozkładających piór drobiowych, które wykazały najwyższą aktywność degradującą pióra w 40 ° C i pH 7.5–8.0. Mikroby degradujące keratynę są szeroko rozpowszechnione wśród populacji drobnoustrojów gleby. Te drobnoustroje mają zdolność do kolonizacji i rozkładu złożonych odpadów rogówki.
Mikroorganizmy keratynofilowe skutecznie degradują odpady keratyny i przetwarzają je w cenne produkty [143]. Możliwe zastosowanie keratynazy jest w różnych zastosowaniach, takich jak w branżach drobiu, biokonwersja odpadów, branże skórzane, branże farmaceutyczne, przetwarzanie tekstylne, formułowanie detergentów, pasza dla zwierząt i nawozy [144, 145, 146].
7. Wnioski
Keratynofilowa mikroflora skutecznie degraduje różne odpady rogówki i wykazały aktywność keratynolityczną. Degradacja odpadów rogówki w sposób biologiczny jest nie tylko ekonomiczny, ale także możliwy proces lepszego zarządzania odpadami rogówki. Mikroorganizmy degradujące keratynę można stosować do zastosowania biotechnologicznego w recyklingu odpadów drobiowych do ochrony środowiska (produkcja nawozów azotowych i pasz dla zwierząt), a jego bulion fermentacyjny może być przydatny w przemyśle skórzanym i przemyśle tekstylnym itp.
Podziękowanie
Dziękujemy dyrektorowi, School of Sciences za zachętę, oraz szefowi Departamentu Biotechnologii, Jecrc University, Jaipur, za zapewnienie obiektów laboratoryjnych.
Bibliografia
- 1. Sabre Wia, El-Metwally MM, El-Hersh MS. Produkcja keratynazy i biodegradacja niektórych odpadów rogówki przez Alternaria tenuissima i Aspergillus nidulans. Research Journal of Microbiology. 2010; 5 (1): 21-35
- 2. Darah I, Nur-Diyana A, Nurul-Husna S, Jain K, Sheh-Hong L. Microsporum fulvum IBRL SD3: Jako nowatorska izolat na degradację piór z kurczaka. Biochemia stosowana i biotechnologia. 2013; 171 (7): 1900-1910
- 3. Mokrejs P, Krejci O, Svoboda P, Vasek V. Modelowanie warunków technologicznych w celu rozbicia wełny owczej odpadów. Rasayan Journal of Chemistry. 2011; 4 (4): 728-735
- 4. Żyusterova A, Braikova D, Goshev I, Christov P, Tishinov K, Vasileva-tonkova E, Haertle T, Nedkov P. Degradacja keratyny i kolagenu zawierających odpady przez nowo izolowane termoaktynomycetete lub hydrolizę alkaliczną. Litery w stosowanej mikrobiologii. 2005; 40 (5): 335-340
- 5. Sousa M, Souza O, Macil M, Cruz R, Rego MG, Magalhaes O, Pessoa-Junior A, Porto A, Souza-Motta C. Potencjał keratynolityczny grzybów izolowanych z gleby zachowanej na Micoteca URM. European Journal of Biotechnology and Bioscience. 2015; 3 (5): 10-15
- 6. Sharma S, Gupta A. Zrównoważone zarządzanie biomasą odpadów keratyny: zastosowania i przyszłe perspektywy. Brazylijskie archiwa biologii i technologii. 2016; 59: E16150684
- 7. Godheja J, Shekhar SK. Biodegradacja keratyny z piór z kurczaka przez gatunki grzybów jako środek zrównoważonego rozwoju. Journal of Bioremediation & Biodegradation. 2014; 5 (5): 232
- 8. Isaac GS, Abu-Tahon MA. Zdolność do dehairingu keratynazy alkalicznej wyprodukowanej przez nowe izolowane Cochliobolus hawaiinsis Aumc 8606 uprawiane na piór kurczaka. Rumuńskie litery biotechnologiczne. 2016; 22 (6): 12147-12154
- 9. Deivasigamani B, Alagappan KM. Przemysłowe zastosowanie keratynazy i rozpuszczalnych białek z keratyny z piór. Journal of Environmental Biology. 2008; 29 (6): 933-936
- 10. Agrahari S, Wadhwa N. Degradacja pióra kurczaka Produkt odpadów drobiowych przez bakterie keratynolityczne izolowane z miejsca zrzutu w ghazipur drobiu zakładu. International Journal of Poultry Science. 2010; 9 (5): 482-489
- 11. Manirujjaman M, Amin R, Nahid AA, Alam MS. Izolacja i charakterystyka bakterii degradujących pióra z odpadów drobiowych. African Journal of Bacteriology Research. 2016; 8 (3): 14-21
- 12. Williams CM, Lee CG, Garlich JD, Shih JCH. Ocena produktu fermentacyjnego pióra bakteryjnego, piórka, jako białko paszowe. Nauka o drobiu. 1991; 70 (1): 85-94
- 13. Kunert J. Fizjologia grzybów keratynofilowych. W: Kushwaha RKS, Guarro J, redaktorzy. Bio-logia dermatofitów i innych grzybów keratynofilowych. Bilbao: Revista Iberoamericana de Micologia; 2000. pp. 77-85
- 14. Sharma R, Rajak RC. Grzyby keratynofilowe: natura’Maszyny degradujące keratynę ich izolację, identyfikację i rolę ekologiczną. Rezonans. 2003; 8 (9): 28-40
- 15. Tridico SR, Koch S, Michaud A, Thomson G, Kirkbride KP, Bunce M. Interpretacja biologicznych procesów degradacyjnych działających na włosy ssaków w żywych i umarłych: które są taponomiczne? Materiały z Królewskiego Towarzystwa B. 2014; 281: 20141755
- 16. Gupta R, Ramnani P. Keratynazy mikrobiologiczne i ich potencjalne zastosowania: przegląd. Mikrobiologia stosowana i biotechnologia. 2006; 70 (1): 21-33
- 17. Brandelli a. Bakteryjne keratynazy: przydatne enzymy do bioprocesowego odpadów rolno i nie tylko. Technologia żywności i bioprocesów. 2008; 1 (2): 105-116
- 18. Sharma R, Swati. Wpływ substratów keratyny na rozwój grzybów keratynofilowych. Journal of Academia and Industrial Research. 2012; 1 (4): 170-172
- 19. Rouse JG, Dyke MEV. Przegląd biomateriałów opartych na keratynie do zastosowań biomedycznych. Materiały. 2010; 3 (2): 999-1014
- 20. Onifade A, al-Sane Na, al-Musalism AA, al-Zarban S. Przegląd: Potencjały zastosowań biotechnologicznych mikroorganizmów degradujących keratynę i ich enzymów w zakresie żywieniowej poprawy piór i innych keratyny jako zasobów karmy żywych. Technologia Biozasobów. 1998; 66 (1): 1-11
- 21. Sapna R, Yamini V. Badanie degradacji keratyny przez niektóre potencjalne izolaty bakteryjne z gleby. Journal of Soil Science. 2011; 1 (1): 01-03
- 22. Lange L, Huang Y, Busk PK. Mikrobiologiczne rozkład keratyny w naturze-nowa hipoteza o znaczeniu przemysłowym. Mikrobiologia stosowana i biotechnologia. 2016; 100 (5): 2083-2096
- 23. Kumawat TK, Sharma A, Bhadauria S. Chrysosporium Queenslandicum: silny grzyb keratynofilowy dla degradacji odpadów rogówki. International Journal of Recycling of Organic Waste w rolnictwie. 2017; 6 (2): 143-148
- 24. Esawy Ma. Izolacja i częściowa charakterystyka pozakomórkowej keratynazy z nowego mezofilnego Streptomyces albus aza. Research Journal of Agriculture and Biological Sciences. 2007; 3 (6): 808-817
- 25. Tork S, Aly MM, Nawar L. Charakterystyka biochemiczna i molekularna nowej lokalnej keratynazy wytwarzającej pseudomomanas sp., MS21. Asian Journal of Biotechnology. 2010; 2 (1): 1-13
- 26. Saibabu V, Niyonzima FN, więcej SS. Izolacja, częściowe oczyszczenie i charakterystyka rogówki z Bacillus megaterium . International Research Journal of Biological Sciences. 2013; 2 (2): 13-20
- 27. Kim Jd. Oczyszczanie i charakterystyka keratynazy z grzyba degradującego pióro, szczep Aspergillus flavus. Mykobiologia. 2007; 35 (4): 219-225
- 28. Sivakumar T, Balamurugan P, Ramasubramanian V. Charakterystyka i zastosowanie enzymu keratynazy przez Bacillus thuringiensis TS2. International Journal of Future Biotechnology. 2013; 2 (1): 1-8
- 29. Sharma M, Sharma M, Rao VM. Biodegradacja keratyny in vitro przez dermatofity i niektóre keratynofile gleby. African Journal of Biochemistry Research. 2011; 5 (1): 1-6
- 30. Sowjanya NC, Chary CM. Degradacja kilku piór Adean przez Microsporum gypseum . Journal of Phytology. 2012; 4 (4): 21-23
- 31. Lin X, Lee CG, Casale ES, Shih JCH. Oczyszczanie i charakterystyka keratynazy z odkształcenia Bacilelus licheniformis odkształcającego pióra. Mikrobiologia stosowana i środowiskowa. 1992; 58 (10): 3271-3275
- 32. Tapia DMT, Contier J. Produkcja i częściowa charakterystyka keratynazy wytwarzanej przez mikroorganizm izolowany z ścieków z przetwórstwa drobiu. African Journal of Biotechnology. 2008; 7 (3): 296-300
- 33. Lin HH, Yin LJ. Pióro posiłku i łuska ryżu wzmocniły produkcję keratynazy przez Bacillus licheniformis YJ4 i postacie produkowanych keratynazy. Journal of Marine Science and Technology. 2010; 18 (3): 458-465
- 34. Sinoy Tes, Bhausaheb CP, Rajendra PP. Izolacja i identyfikacja mikroorganizmu degradowalnego piór. Dziennik techniczny i nietechniczny VSRD. 2011; 2 (3): 128-136
- 35. Vandebergh W, Bossuyt F. Promieniowanie i funkcjonalna dywersyfikacja keratyn alfa podczas wczesnej ewolucji kręgowców. Biologia molekularna i ewolucja. 2012; 29 (3): 995-1004
- 36. Kannahi M, Ancy RJ. Degradacja keratyny i zdolność enzymu Aspergillus flavus i Fusarium solani z gleby. Journal of Chemical and Pharmaceutical Research. 2012; 4 (6): 3245-3248
- 37. Balakumar S, Mahesh N, Arunkumar M, Sivakumar R, Hemambujavalli V. Optymalizacja produkcji keratynazy przez organizmy keratynolityczne w ramach zanurzonej fermentacji. International Journal of PharmTech Research. 2013; 5 (3): 1294-1300
- 38. Lehninger AB, Nelson DL, Cox MM. Zasady biochemii. 2 edycja. New York: Worth Publishers; 1993
- 39. Nickerson WJ. Biologia grzybów patogennych. University of Michigan: Chronica Botanica Co; 1947
- 40. Greenwold MJ, Sawyer RH. Ewolucja molekularna i ekspresja archozaurów β-keratyn: dywersyfikacja i ekspansja archozaurów β-keratyn oraz pochodzenie β-keratyny β piór. Journal of Experimental Zoology Część B: Ewolucja molekularna i rozwój. 2013; 320 (6): 393-405
- 41. Strasser B, Mlitz V, Hermann M, Tschachler E, Eckhart L. Zbieżna ewolucja białek bogatych w cysteinę w piór i włosach. BMC Evolutionary Biology. 2015; 15: 82
- 42. Cai C, Zheng X. Średnia optymalizacja produkcji keratynazy w podłożu do włosów przez nowy Bacillus subtilis KD-N2 przy użyciu metodologii powierzchni odpowiedzi. Journal of Industrial Microbiology and Biotechnology. 2009; 36 (7): 875-883
- 43. Woodin Am. Struktura i skład rozpuszczalnej keratyny z piór. Biochemical Journal. 1956; 63 (4): 576-581
- 44. Shames RB, Knapp LW, Carver WE, Washington LD, Sawyer RH. Keratynizacja zewnętrznej powierzchni skali zczajenia ptaków: powiązanie włókien alfa i beta keratyny w tkance ocisku. Badania komórek i tkanek. 1989; 257 (1): 85-92
- 45. Cranston RW, Davis MH, Scroggie JG. Opracowanie procesu usunięcia Syrolimy. Journal of the American Leather Chemists Association. 1986; 81 (11): 347-355
- 46. Wagner RCC, Joekes I. Usuwanie białka włosów przez dodecylulfan sodu. Koloidy i powierzchnie B: Biointerfaces. 2007; 41 (1): 7-14
- 47. Velasco MVR, Dias TCD, de Freitas AZ, Vieira ND, Pinto CASD, Kaneko TM, Baby AR. Charakterystyka i metody błonnika włosów do oceny właściwości fizycznych i mechanicznych włosów. Brazylijski Journal of Pharmaceutical Sciences. 2009; 45 (1): 153-162
- 48. Nagal S, Jain PC. Degradacja piór przez szczepy Bacillus izolowane z rozkładu piór. Brazylijski Journal of Microbiology. 2010; 41 (1): 196-200
- 49. Kaplin IJ, Schwan A, Zahn H. Wpływ zabiegów kosmetycznych na ultrastrukturę włosów. Kosmetyki i przybory toaletowe. 1982; 97 (8): 22-25
- 50. Gupta a. Ludzki włos “marnować” i jego wykorzystanie: luki i możliwości. Journal of Waste Management. 2014. Identyfikator artykułu: 498018. 17 p. Doi: 10.1155/2014/498018
- 51. Adetola So, Yekini AA, Olayiwola BS. Badanie właściwości fizycznych i mechanicznych kilku wybranych piór z kurczaka powszechnie występujące w Nigerii. IOSR Journal of Mechanical and Civil Engineering. 2014; 11 (3): 45-50
- 52. Bishmi A, thatheyus J, Ramya D. Biodegradacja pióra drobiu przy użyciu nowego bakteryjnego izolatu pseudomonas aeruginosa . International Journal of Research Studies in Microbiology and Biotechnology. 2015; 1 (1): 25-30
- 53. Dagioppo NM, Moreira FG, Costa AM, Alexandrino AM, De Souza CG, Peralta RM. Wpływ źródeł węgla i azotu na produkcję keratynazy przez Myrothecium verrucaria w kulturach zanurzonych i stałych. Journal of Industrial Microbiology and Biotechnology. 2009; 36 (5): 705-711
- 54. Chaturvedi V, Verma P. Metabolizm piór z kurczaka i jednoczesne wytwarzanie energii elektrycznej przez Pseudomonas aeruginosa poprzez zastosowanie drobnoustrojów ogniw paliwowych (MFC). Journal of Waste Management. 2014. Identyfikator artykułu: 928618. 9 p. Doi: 10.1155/2014/928618
- 55. Gupchup GV, Zatz JL. Charakterystyka strukturalna i właściwości przepuszczalności ludzkiego paznokcia: przegląd. Journal of the Society of Cosmetic Chemists. 1999; 50 (6): 363-385
- 56. Frenkel MJ, Gillespie JM. ‘Białka składnika keratyny ptaka’S dziurki. Australian Journal of Biological Sciences. 1976; 29 (5-6): 467-479
- 57. Kakkar P, Madhan B, Shanmugam G. Ekstrakcja i charakterystyka keratyny z kopyta bydła: potencjalny materiał do zastosowań biomedycznych. Springer Plus. 2014; 3 (1): 596
- 58. Mills JS, White R. Chemia organiczna przedmiotów muzealnych. Londyn, Wielka Brytania: Butterworth-Heineman; 1994
- 59. Mikulikova K, Romanov O, Mikik I, Eckhardt A, Pataridis S, Sedlakova P. Badanie rogu SAIGA za pomocą wysokowydajnej chromatografii cieczowej z spektrometrią masową. The Scientific World Journal. 2012. Identyfikator artykułu: 759604. 8 p. Doi: 10.1100/2012/759604
- 60. Romanow Oe. Analiza porównawcza właściwości rogu i ich skład. Badania naukowe Kaukazu. 2005: 91-95
- 61. KIDA K, MORIMURA S, NODA J, NISHIDA Y, IMAI T, OTAGIRI M. Hydroliza enzymatyczna rogu i kopyt. Journal of Fermentacji i bioinżynierii. 1995; 80 (5): 478-484
- 62. Mohamedin Ah. Identyfikacja izolacji i niektóre warunki kulturowe proteazy wytwarzającego termofilne odkształcenie Streptomyces uprawiane na piór kurczaka jako podłoże. Międzynarodowa biodeterioracja i biodegradacja. 1999; 43 (1-2): 13-21
- 63. Huda S, Yang Y. Kompozyty z mielonej piórek kurczaka i polipropylenu. Science i technologia kompozytów. 2008; 68 (3-4): 790-798
- 64. Gerber P, Opio C, Steinfeld H. Produkcja drobiu i środowisko – przegląd. Viale delle terme di Caracalla. Pokój, Włochy: organizacja produkcji i zdrowia zwierząt, Organizacja ds. Żywności i Rolnictwa ONZ; 2007. P. 153
- 65. Deydier E, Guilet R, Sarda S, Sharrock P. Charakterystyka fizyczna i chemiczna surowego mięsa i mączki kości pozostałości: odpady lub surowiec? Journal of Hazardous Materials. 2005; 121 (1-3): 141-148
- 66. Verheyen L, Wiersema D, Hulshoff-Pol L, Brandjes P, Westra P, Bos J, Jansen J. Zarządzanie odpadami z przetwarzania produktów zwierząt. W: zwierzęta gospodarskie i środowisko, znalezienie równowagi. Wageningen, Holandia: Wewnętrzne Centrum Rolnictwa; 1996
- 67. Kanagaraj J, Velappan KC, Chandra Bnk, Sadulla S. Wytwarzanie odpadów solidnych w branży skórzanej i jego wykorzystanie do środowiska czystszego – przegląd. Journal of Scientific and Industrial Research. 2006; 65 (7): 541-548
- 68. Mamushary i, mirutalini v. Zarządzanie odpadami w przemyśle skórzanym – efekty i sugestie dotyczące środowiska i zdrowia w celach budowlanych. International Journal of Civil Engineering & Technology. 2017; 8 (4): 1394-1401
- 69. Wang X, Parsons CM. Wpływ systemów przetwarzania na jakość białek posiłków z piór i posiłki do włosów. Nauka o drobiu. 1997; 76 (3): 491-496
- 70. Syed M, Saleem T, Rehman S, Iqbal MA, Javed F, Khan MB, Sadiq K. Wpływ przemysłu skórzanego na zdrowie i zalecenia dotyczące poprawy sytuacji w Pakistanie. Archiwa zdrowia środowiskowego i zawodowego. 2010; 65 (3): 163-172
- 71. Kumar S, Bhattacharyya JK, Vaidya AN, Chakrabarti T, Devotta S, Akolkar AB. Ocena statusu zarządzania odpadami stałymi komunalnymi w miastach metra, stolic państwowych, miast klasy I i miasteczek klasy II w Indiach: wgląd. Gospodarowanie odpadami. 2009; 29 (2): 883-895
- 72. Jagadeeshgouda KB, Reddy P, Ishwaraprasad K. Eksperymentalne badanie zachowania włókna piór drobiu – materiał wzmacniający dla kompozytów. International Journal of Research in Engineering and Technology. 2014; 3 (2): 362-371
- 73. Ashwathanarayana R, Shashidhara TJ, Naika R. Oznaczanie potencjału keratynolitycznego grzybów keratynolitycznych na próbkach piór drobiu izolowanych z wybranych miejsc drobiu wokół Shivamogga, Karnataka, Indie. International Journal of Science and Research Methodology. 2015; 2 (2): 6-13
- 74. Jayathilakan K, Sultana K, Radhakrishna K, Bawa As. Wykorzystanie produktów ubocznych i materiałów odpadowych z przemysłu mięsa, drobiu i ryb: przegląd. Journal of Food Science and Technology. 2012; 49 (3): 278-293
- 75. Kumawat TK, Sharma A, Bhadauria S. Biodegradacja substratów odpadów rogówki przez Arthroderma multifidum. Asian Journal of Applied Sciences. 2016; 9 (6): 106-112
- 76. Sinkiewicz I, Sliwinska A, Staroszczyk H, Koldziejska I. Alternatywne metody przygotowania rozpuszczalnej keratyny z piór z kurczaka. Waloryzacja odpadów i biomasy. 2017; 8 (4): 1043-1048
- 77. McGovern v. Recykling Puultry Feather: Więcej huk dla CLUCK. Perspektywa zdrowia środowiska. 2000; 108 (8): 336-339
- 78. Tufaner F, avsar y. Wpływ ko-substratu na produkcję biogazu z obornika bydła: przegląd. International Journal of Environmental Science and Technology. 2016; 13 (9): 2303-2312
- 79. Mehta RS, Jholapara RJ, Sawant CS. Izolacja nowej bakterii degradującej pióra i optymalizacja jej warunków kulturowych do produkcji enzymu. International Journal of Pharmacy and Pharmaceutical Sciences. 2014; 6 (1): 194-201
- 80. Ritter WF, Chinside AEM. Wpływ dołów usuwania martwych ptaków na jakość wód gruntowych na półwysep Delmarva. Technologia Biozasobów. 1995; 53 (2): 105-111
- 81. Dube R, Nandan V, Dua S. Spalanie odpadów dla miejskich Indii: cenny wkład w zrównoważony MSWM lub niewłaściwe rozwiązanie zaawansowane technologicznie wpływające na źródła utrzymania i zdrowie publiczne? International Journal of Environmental Technology and Management. 2014; 17 (2/3/4): 199-214
- 82. REMIGIOS MV. Przegląd praktyk zarządzania w miejscach usuwania odpadów stałych w afrykańskich miastach. Journal of Sustainable Development w Afryce. 2010; 12 (7): 233-239
- 83. Tronina P, Bubel F. Produkcja nawozów ekologicznych z odpadów z piór drobiowych z wyłączeniem procesu kompostowania. Polski Journal of Chemical Technology. 2008; 10 (2): 33-36
- 84. Vuppu S, Sinha R, Gupta A, Goyal R. Próba i krótkie badanie w celu wytworzenia toksyny komary za pomocą Bacillus spp. (Vitars), izolowane z różnych próbek gleby (Vellore i Chittoor), przez degradację odpadów z piór z kurczaka. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2012; 3 (4): 40-48
- 85. Ichida JM, Krizova L, Lefevre CA, Keener HM, Elwell DL, Burtt EH. Inokulum bakteryjne zwiększa degradację keratyny i tworzenie biofilmu w kompostu drobiu. Journal of Microbiological Methods. 2001; 47 (2): 199-208
- 86. Tiquia SM. Ocena materii organicznej i składu składników odżywczych częściowo rozłożonej i kompostowanej zużytej ściółki świńskiej. Technologia ochrony środowiska. 2003; 24 (1): 97-107
- 87. Davalos JZ, Roux MV, Jimenez P. Ocena ściółki drobiu jako wykonalnego paliwa. Thermochimica Acta. 2002; 394 (1-2): 261-266
- 88. Thyagarajan D, Barathi M, Sakthivadivu R. Zakres wykorzystania odpadów drobiowych. IOSR Journal of Agriculture and Veterinary Science. 2013; 6 (5): 29-35
- 89. Liu J, Luo Q, Huang Q. Usunięcie 17 β-estradiolu z ściółki drobiowej poprzez kultywację grzybów lignolitycznych w stanie stały. Journal of Cleaner Production. 2016; 139: 1400-1407
- 90. Jaouadi NZ, Rekik H, Badis A, Trabelsi S, Belhoul M, Yahiaoui AB, Aicha HB, Toumi A, Bejar S, Jaouadi B. Biochemiczna i molekularna charakterystyka keratynazy serynowej z Brevibacillus brevis US575 z obiecującą działalnością keratyny biodegrada. PLOS One. 2013; 8 (10): E76722
- 91. Hadas A, Kautsky L. Pióro, półtrusowy nawóz azotowy do hodowli ekologicznej. Badania nawozów. 1994; 38 (2): 165-170
- 92. Latshaw JD, Musharaf N, Retrum R. Przetwarzanie posiłku z piór, aby zmaksymalizować jego wartość odżywczą dla drobiu. Nauka i technologia pasz dla zwierząt. 1994; 47 (3-4): 179-188
- 93. Schmidt WF, Barone JR. Nowe zastosowania piór z kurczaka włókna keratyny. W: National Poultry Waste Management Symposium, w Memphis TN. 2004. pp. 99-101
- 94. Lateef A, oloke JK, Gueguim Keb, Sobowale Bo, Ajao So, Bello by. Działania keratynolityczne nowego izolatu degradującego pióra z Bacillus cereus lau 08 izolowane z gleby nigeryjskiej. Międzynarodowa biodeterioracja i biodegradacja. 2010; 64 (2): 162-165
- 95. Papadopoulos MC. Wpływ przetwarzania na podawania wysokobiałkowe: przegląd. Odpady biologiczne. 1989; 29 (2): 123-138
- 96. Staron P, Kowalski Z, Staron A, Banach M. Termiczne oczyszczanie odpadów z przemysłu mięsnego w piecu obrotowym wysokiej skali. International Journal of Environmental Science and Technology. 2017; 14 (6): 1157-1168
- 97. Karthikeyan R, Balaji S, Sehgal PK. Zastosowania przemysłowe keratyn – przegląd. Journal of Scientific and Industrial Research. 2007; 66 (9): 710-715
- 98. Onooha SC, Chukwura EI. Wpływ temperatury i pH na degradację bakteryjną odpadów z piór z kurczaka (CFW). International Journal of Science and Nature. 2011; 2 (3): 538-544
- 99. Coward-Kelly G, Agbogbo FK, Holtzapple MT. Leczenie wapienne materiałów rogówki do generowania wysoce strawnego paszu zwierząt: 2. Sierść. Technologia Biozasobów. 2006; 97 (11): 1344-1352
- 100. Chojnaca K, Gorecka H, Michalak I, Gorecki H. Recenzja: Valoryzacja materiału rogówki. Waloryzacja odpadów i biomasy. 2011; 2 (3): 317-321
- 101. Tiwary e, gupta r. Szybka konwersja pióra kurczaka do posiłku z piór za pomocą dimerycznej keratynazy z Bacillus licheniformis ER-15. Journal of Bioprocessing & Biotechniques. 2012; 2: 123
- 102. Brandelli A, Salab L, Kalil SJ. Enzymy drobnoustrojowe do biokonwersji odpadów drobiowych do produktów o wartości dodanej. Food Research International. 2015; 73: 3-12
- 103. Staron P, Banach M, Kowalski Z, Staron A. Hydroliza materiałów keratynowych pochodzących z przemysłu drobiu. Postępowanie Ecopole. 2014; 8 (2): 443-448
- 104. Kornillowicz-Kowalska T, Bohacz J. Biodegradacja odpadów keratynowych: teoria i aspekty praktyczne. Gospodarowanie odpadami. 2011; 31 (8): 1689-1701
- 105. Singh I, Kushwaha RKS. Keratynazy i degradacja drobnoustrojów keratyny. Postępy w badaniach nadawczych. 2015; 6 (2): 74-82
- 106. Riffel A, Lucas FS, Heeb P, Brandelli A. Charakterystyka nowej bakterii keratynolitycznej, która całkowicie degraduje natywną keratynę piór. Archiwa mikrobiologii. 2003; 179 (4): 258-265
- 107. Anbu P, Hilda A, Sur HW, Hur BK, Jayanthi S. Pozakomórkowa keratynaza z Tricho-Phyton Sp. HA-2 odizolowane od gleby zrzucającej pióra. Międzynarodowa biodeterioracja i biodegradacja. 2008; 62 (3): 287-292
- 108. Kansoh AL, Hossiny EN, Hameed EK. Produkcja keratynazy z odpadów piór. Australian Journal of Basic and Applied Sciences. 2009; 3 (2): 561-571
- 109. Brandelli A, Daroit DJ, Riffel A. Cechy biochemiczne keratynaz drobnoustrojów oraz ich produkcja i zastosowania. Mikrobiologia stosowana i biotechnologia. 2010; 85 (6): 1735-1750
- 110. Revathi K, Viruthagiri T. Optymalizacja parametrów procesu dla produkcji enzymu keratynazy przy użyciu statystycznego projektu eksperymentalnego. International Journal of Engineering and Innovative Technology. 2016; 6 (1): 14-21
- 111. Zakupione. Keratynazy mikrobiologiczne: charakterystyka, zastosowania biotechnologiczne i potencjał. W: Gupta VK, Sharma GD, Tuohy MG, Gaur R, redaktorzy. Podręcznik drobnoustrojów Bioresources. Wallingford, Wielka Brytania: CAB International Publishing; 2016. pp. 634-674
- 112. Govarthanan M, Selvankumar T, Selvam K, Sudhakar C, Aroulmoji V, Kamala-Kannan S. Metodologia powierzchni odpowiedzi optymalizacja produkcji keratynazy z odpadów z piór i odpadów rogu obróbki alkalicznej za pomocą Bacillus Sp. Mg-Masc-Bt. Journal of Industrial and Engineering Chemistry. 2015; 27: 25-30
- 113. Sharma A, Chandra S, Sharma M. Różnica w aktywności keratynazy dermatofitów w różnych warunkach środowiskowych jest atrybutem adaptacji do pasożytnictwa. Mycoses. 2012; 55 (5): 410-415
- 114. Kublanov IV, Tsiroulnikov KB, Kaliberda EN, Rumsh LD, Haertle T, Bonch-Osmolovskaya EA. Keratynaza beztlenowej termofilowej bakterii termoanaerobacter sp. Odkształcenie 1004-09 izolowane z gorącej sprężyny w strefie szczelin Bajkal. Mikrobiologia. 2009; 78 (1): 67-75
- 115. Tork SE, Shahein YE, El-Hakim AE, Abdel-ATY AM, Aly MM. Oczyszczanie i częściowa charakterystyka serynowo-metalokeratynazy z nowo izolowanego Bacillus pumilus NRC21. International Journal of Biological Macromolecules. 2016; 86: 189-196
- 116. Suzuki Y, Tsujimoto Y, Matsui H, Watanabe K. Rozkład niezwykle trudno do degradowania białek zwierzęcych przez bakterie termofilowe. Journal of Bioscience and Bioingineering. 2006; 102 (2): 73-81
- 117. Marchisio VF. Grzyby keratynofilowe: ich rola w naturze i degradacja substratów keratynowych. W: Kushwaha RKS, Guarro J, redaktorzy. Biologia dermatofitów i innych grzybów keratynofilowych. Bilbao: Revista Iberoamericana de Micologıa; 2000. pp. 86-92
- 118. Blyskal b. Grzyby wykorzystujące podłoża rogówki. Międzynarodowa biodeterioracja i biodegradacja. 2009; 63 (6): 631-653
- 119. Soomro IH, Kazi YF, Zardari M, Shar AH. Izolacja grzybów keratynofilowych z gleby w Khairpur City, Sindh, Pakistan. Bangladesz Journal of Microbiology. 2007; 24 (1): 79-80
- 120. Ajello L. Dermatofit, mikrosporum gipseum, jako saprofit i pasożyt. Journal of Investigative Dermatology. 1953; 21 (3): 157-171
- 121. Lee MJ, Park JS, Chung H, Jun JB, Bang YJ. Rozkład grzybów keratynofilowych gleby izolowanych na letnich plażach Morza Wschodniego w Korei. Korean Journal of Medical Mycology. 2011; 16 (2): 44-50
- 122. Sharma M, Sharma M. Występowanie dermatofitów i innych grzybów keratynofilowych w glebach placu zabaw dla szkół i college’u w Jaipur w Indiach. African Journal of Microbiology Research. 2010; 4 (24): 2647-2654
- 123. Rizwana H, Abdulaziz A, Hazzani A, Siddiqui I. Częstość występowania dermatofitów i innych grzybów keratynofilowych z gleb publicznych parków i placów zabaw Rijadu, Arabia Saudyjska. The Journal of Animal & Plant Sciences. 2012; 22 (4): 948-953
- 124. Kumar R, Mishra R, Maurya S, Sahu B. Częstość występowania grzybów keratynofilowych w glebach higgeryjnych Jharkhand w Indiach. Międzynarodowy kwartalnik Journal of Environmental Science. 2012; 1: 93-98
- 125. Malek E, Moosazadeh M, Hanafi P, Nejat Za, Amini A, Mohammadi R, Kohsar F, Niknejad F. Izolacja grzybów keratynofilowych i aerobowych aktynomycetetów z gleb parkowych w Gorgan, na północ od Iranu. Jundishapur Journal of Microbiology. 2013; 6 (10): E11250
- 126. Tambekar DH, Mendhe SN, Gulhane SR. Występowanie dermatofitów i innych grzybów keratynolitycznych w glebie Amravati (Indie). Trendy w naukach o nauk stosowanych. 2007; 2 (6): 545-548
- 127. Kumawat TK, Sharma V, Seth R, Sharma A. Różnorodność degradującej keratyny flory grzybowej w obszarze przemysłowym Jaipur i potencjał keratynolityczny Trichophyton mentagrophytes i Microsporum canis . International Journal of Biotechnology and Bioengineering Research. 2013; 4 (4): 359-364
- 128. Sangali S, Brandelli A. Hydroliza keratyny z piór przez vibrio sp. szczep KR2. Journal of Applied Microbiology. 2000; 89 (5): 735-743
- 129. Lucas FS, Broennimann O, Febbraro I, Heeb P. Wysoka różnorodność wśród bakterii degradujących pióra z suchej gleby łąki. Ekologia drobnoustrojów. 2003; 45 (3): 282-290
- 130. Ramnani P, Singh R, Gupta R. Potencjał keratinolityczny Bacillus licheniformis RG1 Strukturalny i biochemiczny mechanizm degradacji piór. Canadian Journal of Microbiology. 2005; 51 (3): 191-196
- 131. Sivakumar T, Shankar T, Ramasubramanian V. Właściwości oczyszczania enzymu keratynazy Bacillus thuringiensis TS2. American-Eurasian Journal of Agricultural & Environmental Sciences. 2012; 12 (12): 1553-1557
- 132. Riffel A, Brandelli A. Bakterie keratynolityczne izolowane z odpadów z piór. Brazylijski Journal of Microbiology. 2006; 37 (3): 395-399
- 133. Vigneshwaran C, Shanmugam S, Kumar TS. Badanie przesiewowe i charakterystyka keratynazy z Bacillus licheniformis izolowane z Namakkal Puultry Farm. Badania. 2010; 2 (4): 89-96
- 134. Vanbreuseghem r. Technika biologiczna pour l’Izolarka. Annales de la Societe Belge de Medecine Tropicale. 1952; 32: 173-178
- 135. Otcenasek m. Ekologia dermatofitów. Mycopathologia. 1978; 65 (1-3): 67-72
- 136. Kumawat TK, Sharma A, Bhadauria S. Wpływ płynnych pożywek hodowlanych, temperatury i stężenia jonów wodorowych na wzrost grzybni i sporulacja Arthroderma multifidum . International Journal of Pharmaceutical Sciences Review and Research. 2016; 41 (2): 136-141
- 137. Zhao H, Huang L, Xiao CL, Liu J, Wei J, Gao X. Wpływ kultury mediów i czynników środowiskowych na wzrost grzybni i konidialną produkcję Diplocarpon Mali . Litery w stosowanej mikrobiologii. 2010; 50 (6): 639-644
- 138. Kumawat TK, Sharma A, Bhadauria S. Wpływ mediów kultutycznych i warunków środowiskowych na wzrost grzybni i sporulowanie chrysosporium Queenslandicum . International Journal of Chemtech Research. 2016; 9 (11): 271-277
- 139. Sharma A, Sharma M, Chandra S. Wpływ temperatury i wilgotności względnej na wzrost i sporulowanie niektórych wspólnych dermatofitów. Indian Journal of Fundamental and Applied Life Sciences. 2012; 2 (4): 1-6
- 140. Gopinath SCB, Anbu P, Lakshmipriya T, Tang TH, Chen Y, Hashim U, Ruslinda AR, MD Arshad MK. Aspekty biotechnologiczne i perspektywa produkcji keratynazy drobnoustrojów. Biomed Research International. 2015. Identyfikator artykułu: 140726. 10 p. Doi: 10.1155/2015/140726
- 141. Williams CM, Richter CS, Mackenzie JM, Shih JCH. Izolacja, identyfikacja i charakterystyka bakterii degradującej pióra. Mikrobiologia stosowana i środowiskowa. 1990; 56 (6): 1509-1515
- 142. Cao ZJ, Zhang Q, Wei DK, Chen JW, Zhang XQ, Zhou MH. Charakterystyka nowego izolatu stenotrofomonu z wysoką aktywnością keratynazy i oczyszczanie enzymu. Journal of Industrial Microbiology and Biotechnology. 2009; 36 (2): 181-188
- 143. Umedum Cu, Ugorji IR, Okoye EC, Egemonye OC, OBIORA SO. Aktywność keratynazy i właściwości biodegradacji grzybów hyphomycetowych z piór ptactwa. International Journal of Agriculture and Biosciences. 2013; 2 (6): 306-309
- 144. Aderee ia, Lateef a. Keratynazy: pojawiające się trendy w produkcji i zastosowania jako nowe wielofunkcyjne biokatalizatory. Kuwejt Journal of Science. 2016; 43 (3): 118-127
- 145. Mini KD, Paul MK, Mathew J. Badanie grzybów izolowanych z gleby farm drobiu w celu uzyskania aktywności keratynolitycznej. Postępy w badaniach nadawczych. 2012; 3 (4): 2073-2077
- 146. Nigam Ps. Enzymy drobnoustrojowe o specjalnych cechach dla zastosowań biotechnologicznych. Biomolekuły. 2013; 3 (3): 597-611
Sekcje
- 1. Wstęp
- 2. Białko keratyny
- 3. Główne źródło białka keratyny
- 4. Wpływ odpadów keratyny na zanieczyszczenie środowiska i zdrowie ludzkie
- 5. Tradycyjne strategie usuwania odpadów keratyny i ich wad
- 6. Techniki hydrolizy odpadów keratynowych
- 7. Wnioski
- Podziękowanie


